肝臓
(写真にカーソルを置くと、モノクロはカラーになります。また、クリックすると別ウィンドウで拡大表示します。)
正立顕微鏡と吸引型の固定装置を用いることで簡単に観察することができます。
- イソフルランなどの麻酔薬を麻酔装置にて使用し、マウスを寝かせます。以下の作業はすべて麻酔下で行います。
- マウスを仰向けに寝かせ、両手両足をテープなどで貼り付けます手足が邪魔にならないようにしてから、腹部をバリカンで剃ります。(写真1)
- 腹部にエタノールをふきつけ、切開時に体毛が邪魔にならようにします。
- マウス腹部の皮膚を正中線に沿って剣状突起あたりからその下1.5cmほどはさみとピンセットを用いて切開します。(写真2)
- 皮膚をピンセットや麺棒を用いて左右に開いてから、筋肉層も皮膚同様に正中線にそって剣状突起から下の部分を縦に切開します。
注)出血が生じたら麺棒で強く抑えて30秒〜1分くらい待ってください。そのうち出血はとまります。それでも出血が止まらなければ電気メスを用いて出血部を焼いて止血してください。 - 麺棒を2つ用いて切開部から肝臓の観察したい部位を引っ張って表に露出させてください。(写真3)
注)肝臓の観察部位を引っ張り出す際に、ピンセットを用いると出血することがあります。ピンセットよりも麺棒のような柔らかいもので引っ張り出すほうが安全です。また、観察部位に付いた毛や麺棒の糸などが付着している場合はPBSで洗ったりして取り除いてください。 - 吸引型固定装置のステージの上にヒートプレートを敷きます。このとき、キムタオルのような紙をヒートプレートの上に敷くと後片付けが簡便になります。
- マウスをヒートプレートの上に置き、吸引型固定装置の底面を観察したい肝臓の部位の上に近づけ、吸引を開始します。このとき水銀ランプで対物レンズ下を照明すると、どこが吸引される場所であるかが分かりやすくなります。吸引圧は低くても大丈夫です。吸引圧は20-30mmHg程度にします。(写真4)
- 顕微鏡でのイメージングを行います。
動画撮影
レーザアブレーション実験
MP4 動画を見る
MKV 動画を見る
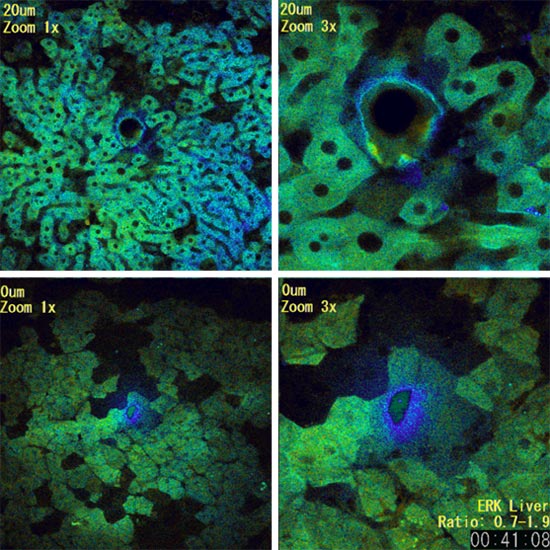
肝臓でのレーザアブレーション損傷による炎症反応を観察。撮影開始30分後にレーザで損傷を与えました。リンパ系細胞であるクッパー細胞が炎症部位に集まる様子が分かります。下部の画像を基準にZ方向へ、0um、20umの2枚のZスタックを取っています。また、左部はズーム倍率を1x、右部は中心部分をズーム倍率3xと拡大したものです。肝臓細胞内のERKの活性の様子をFRET(CFP-YFP)にて観察。上部のイメージは擬似カラーを使用、ERKの活性が高いものが赤、低いものが青く表示されるようにしてあります。
| 画像撮影条件 | |
|---|---|
| マウス | Eisuke |
| 顕微鏡 | FV1000-MPE |
| 対物レンズ | XLPLN25xWMP |
| レーザ波長 | 840nm |
| レーザパワー | 5.0% Maitai 出力: 2.5W、対物出力:約 ○○〜○○mW(要相談) |
| Speed | 20us/pxl |
| 観察エリア | XY:512x512 pxl、左:Zoom 1x (250x250um) 右:Zoom3x(約100x100um) Z:0um(下)と20um(上)の2箇所 40秒間隔 200枚 約2.5時間のタイムラプス |
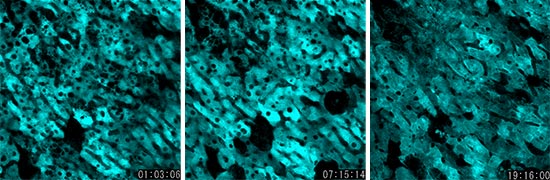
肝臓の一部を切り取った6日後に、残った肝臓の様子をCFPにて観察しています。肝臓再生時に見られる油滴が多くの細胞内にあることが確認できます。観察開始から16時間後にマウスが死亡したため、撮影開始から20時間後を撮影した一番右の画像では細胞の様子が他の2枚の画像とは違うことが分かります。
| 画像撮影条件 | |
|---|---|
| マウス | Eisuke |
| 顕微鏡 | FV1000-MPE |
| 対物レンズ | XLPLN25xWMP |
| レーザ波長 | 840nm |
| レーザパワー | 15mW(対物出射) |
| Speed | 20us/pxl |
| 観察エリア | XY:512x512 pxl、左:Zoom 1.2x (400x400um) 3分間隔 397枚 約20時間のタイムラプス |